Dacă atomii sunt în mare parte spațiu gol, de ce obiectele arată și se simt solide la atingere?
Acum două secole, chimistul John Dalton a propus ideea că toate corpurile sunt alcătuite din particule numite atomi. Fiecare atom este compus dintr-un nucleu incredibil de mic și din electroni, care sunt chiar și mai mici.
 Dacă vă imaginați o masă normală, dar de 1 miliard de ori mai mare, atunci atomii săi ar fi de dimensiunea pepenilor. Dar chiar și așa, nucleul din centrul atomilor ar fi în continuare mult prea mic pentru a fi observat cu ochiul liber. Iar restul, spațiu gol. Imaginați-va că vă sprijiniți cu mâna de masă. De ce nu trec degetele noastre prin atomi dacă majoritatea spațiului ce formează atomul este gol? Ei bine, în primul rând, atomii nu sunt goi. Potrivit electrodinamicii cuantice, spațiul este umplut de un câmp de electroni în jurul nucleului care neutralizează sarcina și umple spațiul care definește dimensiunea atomului.
Dacă vă imaginați o masă normală, dar de 1 miliard de ori mai mare, atunci atomii săi ar fi de dimensiunea pepenilor. Dar chiar și așa, nucleul din centrul atomilor ar fi în continuare mult prea mic pentru a fi observat cu ochiul liber. Iar restul, spațiu gol. Imaginați-va că vă sprijiniți cu mâna de masă. De ce nu trec degetele noastre prin atomi dacă majoritatea spațiului ce formează atomul este gol? Ei bine, în primul rând, atomii nu sunt goi. Potrivit electrodinamicii cuantice, spațiul este umplut de un câmp de electroni în jurul nucleului care neutralizează sarcina și umple spațiul care definește dimensiunea atomului.
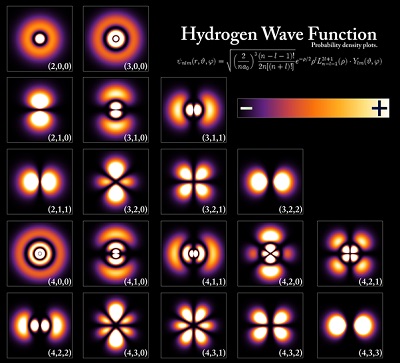
Pentru a explica de ce obiectele se simt solide la atingere, trebuie să ne uitam la electroni. Din păcate, o mare parte din ceea ce este predat în școala generală este simplificat – electronii nu orbitează centrul unui atom așa cum planetele orbitează în jurul Soarelui. Trebuie să ne gândim la electroni ca la un roi de albine sau păsări, unde mișcările individuale sunt prea rapide pentru a le urmări, însa putem vedea urmele lăsate, precum în imaginea de mai sus.
Dansul electronilor
Electronii practic dansează în jurul atomului. Însă nu dansează într-un mod haotic, ci seamănă mai mult cu un dans în sala de bal, urmând șabloane și pași preciși, stabiliți de o ecuație matematică, numită după Erwin Schrodinger.
Aceste șabloane pot varia – unele sunt lente, precum un vals, în timp ce altele sunt rapide și energice. Fiecare electron păstrează același șablon, dar din când în când și-l poate schimba, atâta timp cât niciun alt electron nu dansează deja după acel șablon. Doi electroni dintr-un atom nu pot dansa în același pas, iar aceasta regula se numește Principiul de excluziune.
Principiul de excluziune, numit și Principiul Pauli, este un principiu din mecanica cuantică, formulat de Wolfgang Pauli în 1925. Acesta afirmă că doi fermioni identici nu pot ocupa aceeași stare cuantică simultan. Pentru electronii dintr-un singur atom, înseamnă că doi electroni nu pot avea aceleași patru numere cuantice. Deoarece electronii sunt fermioni, acest principiu le interzice să ocupe aceeași stare cuantică.
Deși electronii nu obosesc niciodată, trecerea la un pas mai rapid necesită energie.
Rezistența la atingere
De ce o masă se simte solidă la atingere? Multe site-uri web va vor spune că acest lucru se datorează respingerii – că două lucruri încărcate negativ trebuie să se respingă reciproc. O explicație mai realistă este că masa se simte solidă datorită dansului electronilor despre care am menționat mai sus.
Atunci când atingi masa, electronii din degetele tale se apropie de electronii din atomii mesei. Pe măsură ce electronii dintr-un atom se apropie destul de mult de nucleul celuilalt, dansul se schimbă. Un electron aflat pe un nivel energetic inferior nu se poate afla pe același nivel energetic în jurul unui alt nucleu, dat fiind ca acest nivel este deja ocupat de unul dintre electronii celuilalt atom. Așadar, electronul primului atom trebuie să ocupe un nivel energetic mai ridicat în jurul celui de-al doilea. Această energie suplimentară este generata de forța de respingere a degetului asupra atomilor mesei.
Așadar, pentru a împinge doi atomi aproape unul de celălalt necesită energie pentru că toți electronii lor trebuie să treacă pe un nivel energetic superior neocupat. Încercarea de a apropia atomii din deget de masă necesită o cantitate mult mai mare decât cea furnizată de mușchii noștri.
Ceea ce atingem este de fapt un câmp creat de electroni și a cărei masă este creată de nuclee. Masa, în general, se datorează forței nucleare tari, generată prin ruperea simetriei.
Când se ating doi atomi sau două molecule, se ating câmpurile lor de electroni și se resping reciproc. Într-o mică măsură se și atrag, numita atracția van der Walls, responsabilă de formarea lichidelor. Astfel, atingerea este un efect real.
Traducere și adaptare după:
https://theconversation.com
https://www.mat.univie.ac.at