Nu toate elementele din tabelul periodic au fost create în universul timpuriu, după Big Bang. De fapt, la începutul universului au fost create doar câteva elemente chimice: hidrogenul, heliu și într-o cantitate mai mică, litiul, dar și câțiva izotopi (precum deuteriul, un izotop de hidrogen).
Nu toate elementele din tabelul periodic au fost create în universul timpuriu, după Big Bang. De fapt, la începutul universului au fost create doar câteva elemente chimice: hidrogenul, heliu și într-o cantitate mai mică, litiul, dar și câțiva izotopi (precum deuteriul, un izotop de hidrogen).
Primii atomi
Big Bang-ul nu a putut produce atomi mai grei decât litiul datorită unei probleme: absența unui nucleu stabil cu 8 sau 5 nucleoni. Acest deficit de atomi mai mari a limitat cantitățile de litiu-7 produse în timpul nucleosintezei. În stele, acest blocaj este depășit datorită setului de reacții numit “procesul triplu-alfa” în care trei nuclee de heliu-4 sunt transformate în carbon (număr atomic 8).
Atunci când Universul s-a extins, materia a început să se răcească. Deoarece temperatura este o unitate de măsură a energiei, sau a vitezei cu care se agită atomii, aceasta răcire a universului a avut un efect important: la temperaturi foarte înalte, particulele se mișcă atât de repede încât acestea pot scăpa de orice atracție, dar o data cu răcirea universului (deci cu scăderea energiei), protonii și neutronii nu au mai avut suficientă energie pentru a scăpa de atracția forței nucleare tari și au putut să formeze atomii de deuteriu (izotop de hidrogen).
Universul era o plasmă opacă. După 47.000 de ani, în timp ce se răcea, universul începea să fie dominat mai degrabă de materie decât de radiații. Universul devenea în sfârșit suficient de rece pentru ca atomii neutri să se recombine. În perioada numită “Dark age”, ce a durat de la 377.000 de ani până la aproximativ 1 miliard de ani după Big Bang, norii de hidrogen au început încet să colapseze sub forța gravitației.
O data cu expansiunea Universului, acesta a continuat să se răcească. Putem să ne gândim la un deodorant spray, atunci când îl folosim, simțim recipientul rece. Asta se datorează faptului că gazul atunci când se decomprimă se răcește. În regiunile unde gazul s-a aflat într-o concentrație mai mare, a atras gravitațional din ce în ce mai mult gaz, concentrându-l sub propria gravitație. În astfel de regiuni concentrate de gaz au apărut primele galaxii și stele.
Cele mai simple elemente chimice
Fiecare element chimic are un număr unic de protoni (particule subatomice cu sarcină pozitivă) și neutroni (fără sarcină electrică). Toți atomii conțin neutroni, cu excepția unuia: atomul de hidrogen. Hidrogenul este cel mai simplu element chimic având un singur proton și un singur electron (sarcină electrică negativă), ceea ce explică și faptul de ce este cel mai abundent în Univers. Abundența unui element chimic scade exponențial cu greutatea atomică.
Numărul atomic al unui element chimic este de fapt numărul de protoni din respectivul element. De exemplu, aurul are numărul atomic 79. Acest lucru ne spune că un atom de aur are 79 de protoni în nucleul său. Ceea ce este interesant, este că fiecare atom de aur conține 79 de protoni. Dacă un atom nu are 79 de protoni, acesta nu poate fi un atom de aur. Adăugarea sau eliminarea protonilor din nucleul unui atom creează un element chimic diferit. De exemplu, îndepărtarea unui proton dintr-un atom de aur va crea un atom de platină, iar adăugarea unui proton va crea unul de mercur.
Numărul neutronilor este în general egal cu numărul protonilor. Dacă numărul de neutroni diferă de numărul de protoni, spunem despre acel element că este un izotop.
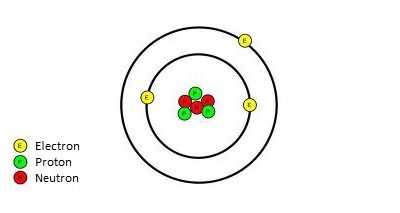 Toate elementele mai grele decât litiul (în imagine) au fost create mult mai târziu, în stele, prin nucleosinteză. În interiorul stelelor, atomii de hidrogen fuzionează pentru a crea atomii de heliu (având doar 2 protoni, 2 neutroni și 2 electroni) – al doilea element cel mai comun în Univers. Împreună, heliul și hidrogenul formează aproximativ 98% din materia cunoscută în Univers.
Toate elementele mai grele decât litiul (în imagine) au fost create mult mai târziu, în stele, prin nucleosinteză. În interiorul stelelor, atomii de hidrogen fuzionează pentru a crea atomii de heliu (având doar 2 protoni, 2 neutroni și 2 electroni) – al doilea element cel mai comun în Univers. Împreună, heliul și hidrogenul formează aproximativ 98% din materia cunoscută în Univers.
Oxigenul este cel de-al treilea element din punct de vedere al abundenței, însă într-o cantitate de aproximativ 1000 de ori mai mică decât hidrogenul. Atomul de oxigen conține 8 protoni și 8 neutroni. Practic, cu cât numărul atomic este mai mare, cu atât elementul chimic este mai rar găsit.
Compoziția Pământului este însă diferită, de exemplu, oxigenul este cel mai abundent element chimic după greutate (46%), urmat de siliciu (28%), aluminiu (8,2%), fier (5,6%), calciu (4,2%), sodiu (2,5%), magneziu (2,4 %), potasiu (2 %) și titan (0,61 %). Restul elementelor există pe Terra într-un procent de sub 0,15%. În corpul uman, cel mai comun element chimic este oxigenul, urmat de carbon și hidrogen.
Cele mai grele elemente chimice
Primele 94 de elemente chimice din tabelul periodic, până la plutoniu, apar în mod natural. Elementele chimice care au mai mult de 94 de protoni au fost create artificial. Deși tabelul periodic conține 118 tipuri de atomi, este posibil ca numărul lor să crească în viitorul apropiat.
Deoarece protonii au o sarcină pozitivă, aceștia au tendința să se respingă. Ceea ce ține protonii și neutronii laolaltă este o forță misterioasă numită interacțiunea tare, care este de 100 de ori mai puternică decât forța electromagnetică. Un atom cu peste 94 de protoni este extrem de instabil și se dezintegrează foarte rapid. Cel mai greu atom realizat în laborator este Oganesson și are 118 protoni și o durată de viață de 0,89 milisecunde.
Distribuția elementelor chimice
Sistemul nostru solar este rezultatul colapsului gravitațional al unei mici părți de nor gigantic. Compoziția sistemului nostru solar este asemănătoare cu alte sisteme din vecinătatea noastră, însă există mici variații în cantitățile de hidrogen și heliu pe de-o parte, și carbon și elemente mai grele, pe de altă parte. Hidrogenul și heliul sunt “relicve” ale Big Bang-ului în timp ce elementele mai grele rezultă din reacțiile nucleare din stele.
 Carbonul și elementele mai grele tind să fie mai prezente în centrul galaxiilor mari (precum galaxia noastră) decât la periferia lor sau în galaxii mici.
Carbonul și elementele mai grele tind să fie mai prezente în centrul galaxiilor mari (precum galaxia noastră) decât la periferia lor sau în galaxii mici.
În cazul elementelor mai ușoare decât fierul (masă atomică 56), fuziunea nucleară eliberează energie în timp ce fisiunea o consumă. Elementele precum fierul sau mai grele decât fierul, fuziunea nucleară consumă energie iar fisiunea nucleară o eliberează. Elementele chimice până la fier sunt produse în nucleosinteza stelară obișnuită, în timp ce elementele mai grele sunt produse numai în nucleosinteza supernovelor.
 Distribuția și cantitățile elementelor chimice se schimbă în timp. Abundența anumitor elemente chimice sunt precum ridurile de pe fețele noastre, un fel de ceas galactic care arată cât mai are de trăit un sistem. Există o relație între vârsta unei stele și abundența fierului: în medie, stelele vechi conțin mai puțin fier decât cele tinere. Pe de altă parte, abundența elementelor chimice precum fierul sau alte elemente mai grele crește în mediul interstelar o dată cu timpul, o dată cu trecerea mai multor generații de stele.
Distribuția și cantitățile elementelor chimice se schimbă în timp. Abundența anumitor elemente chimice sunt precum ridurile de pe fețele noastre, un fel de ceas galactic care arată cât mai are de trăit un sistem. Există o relație între vârsta unei stele și abundența fierului: în medie, stelele vechi conțin mai puțin fier decât cele tinere. Pe de altă parte, abundența elementelor chimice precum fierul sau alte elemente mai grele crește în mediul interstelar o dată cu timpul, o dată cu trecerea mai multor generații de stele.
Ciclul organic – materia vie
Materia vie este capabilă să își obțină elementele chimice necesare și să se reproducă. Aceste condiții sunt probabil universale, indiferent de mediul în care trăiește. Pe Pământ, ciclul organic include cele 11 elemente: H, C, N, O, Na, Mg, P, S, CI, K și Ca, care formează cea mai mare parte a materiei vii. Toate aceste elemente chimice au un număr atomic mic și aparțin celor mai mici 20 de elemente ale tabelului periodic. Aceste elemente sunt, de asemenea, cele mai abundente în Univers.
Cele mai puțin necesare dintre elementele ușoare, excluzând gazele nobile, sunt Li, Be, B (borul este esențial pentru unele plante) și Al. În plus, există o serie de elemente care au fost recunoscute ca esențiale pentru animalele cu sânge cald: F, Si, V, Cr, Mo, Fe, Ni, Cu, Zn, Se, Mo, Sn, I și W. Niciun element dincolo de tungsten (număr atomic 74) nu s-a arătat ca ar avea vreo utilitate din punct de vedere biologic.
Datele observate în regiunea noastră cosmică sunt atribuite principiului antropic. Adică observațiile din universul fizic trebuie să fie compatibile cu viața conștientă care le observă. Poate că universul este așa cum este pentru că dacă ar fi fost altfel, n-am mai fi aici pentru a-l observa.
 Norii interstelari sunt adevărate fabrici de elemente grele. Foarte multe molecule utilizate în biochimie se găsesc în mediul interstelar, în alte atmosfere, pe alte planete, comete, asteroizi și meteoriți. Viața așa cum o știm, (H-C-N-O), poate apărea oriunde condițiile îi permit. Procesul primordial care transformă norii enormi de praf cosmic în planete a fost observat recent. O protoplanetă ce se află în jurul stelei LkCa15, la o distanță de 450 de ani lumină, ar putea fi un nou Pământ. Pe lângă aceasta, alte mii de planete au fost observate în locații unde viața ar putea să existe.
Norii interstelari sunt adevărate fabrici de elemente grele. Foarte multe molecule utilizate în biochimie se găsesc în mediul interstelar, în alte atmosfere, pe alte planete, comete, asteroizi și meteoriți. Viața așa cum o știm, (H-C-N-O), poate apărea oriunde condițiile îi permit. Procesul primordial care transformă norii enormi de praf cosmic în planete a fost observat recent. O protoplanetă ce se află în jurul stelei LkCa15, la o distanță de 450 de ani lumină, ar putea fi un nou Pământ. Pe lângă aceasta, alte mii de planete au fost observate în locații unde viața ar putea să existe.
Bibliografie:
https://www.livescience.com
https://arxiv.org
http://www.chemeurope.com
https://en.wikipedia.org