Există probabil peste 100 de miliarde de planete în galaxia noastră, iar Pamantul, un avanpost singuratic aflat pe unul din brațele spiralate ale galaxiei, este singura planetă cunoscută capabilă să susțină viață. Am început de câteva secole să privim spre stele, spre alte lumi și chiar am analizat compoziția atmosferei lor prin disecarea acelor urme firave de lumină provenite de la ele, încercand să descoperim dacă conține compușii chimici ce stau la baza vieții.
 Însă viața pe alte planete poate fi foarte diferită față de ce găsim pe Pământ. O astfel de formă de viață ar putea folosi un alt element chimic decât carbonul sau să nu folosească apa ca solvent. Unele caracteristici ale vieții de pe Terra sunt universale, în special cerința de neechilibru termodinamic. Însa alte criterii nu sunt neapărat necesare.
Însă viața pe alte planete poate fi foarte diferită față de ce găsim pe Pământ. O astfel de formă de viață ar putea folosi un alt element chimic decât carbonul sau să nu folosească apa ca solvent. Unele caracteristici ale vieții de pe Terra sunt universale, în special cerința de neechilibru termodinamic. Însa alte criterii nu sunt neapărat necesare.
(Foto: concepție artistică cu privire la modul în care ar putea arăta o planetă cu viață pe baza de amoniac).
Organismele vii cunoscute pe Pământ utilizează compușii de carbon pentru a forma funcțiile structurale și metabolice, folosesc apa ca solvent și ADN-ul și ARN-ul pentru stocarea instrucțiunilor necesare vieții. Dacă există viață pe alte planete, e posibil să fie similară din punct de vedere chimic cu viața de pe Terra; este, de asemenea, posibil să existe organisme cu o chimie destul de diferită – de exemplu, implicând alți compuși sau folosind un alt solvent în locul apei.
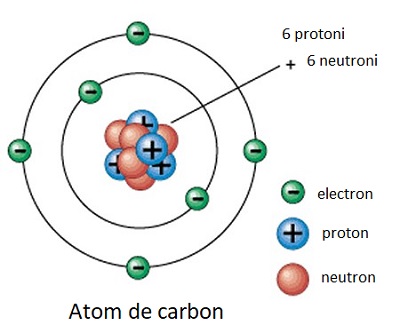 Siliciul a fost propus ca o alternativă ipotetică la carbon. Siliciul se află în aceeași grupă cu carbonul în tabelul periodic și, la fel precum carbonul, siliciul este tetravalent, deși compușii acestora sunt mai puțin stabili. Alternativele la apă ca solvent includ amoniacul, care, la fel ca apa, este o moleculă polară; și solvenți nepolari de hidrocarburi, precum metanul și etanul, care sunt prezenți în formă lichidă pe suprafața Titanului.
Siliciul a fost propus ca o alternativă ipotetică la carbon. Siliciul se află în aceeași grupă cu carbonul în tabelul periodic și, la fel precum carbonul, siliciul este tetravalent, deși compușii acestora sunt mai puțin stabili. Alternativele la apă ca solvent includ amoniacul, care, la fel ca apa, este o moleculă polară; și solvenți nepolari de hidrocarburi, precum metanul și etanul, care sunt prezenți în formă lichidă pe suprafața Titanului.
Pe Pământ, ființele vii au nevoie de carbon, însa Carl Sagan spune că nu putem fi siguri că viața funcționează la fel peste tot în Univers. El a considerat siliciul și germaniul drept alternative pentru carbon, dar, pe de altă parte, a observat că atomii de carbon par mai versatili din punct de vedere chimic și sunt mai abundenți în Univers.
Biochimia vieții pe Pământ
Pentru a forma elemente chimice, atomii trebuie să formeze molecule, iar pentru asta, trebuie să existe o legătură chimica între ei, mai exact, o legătură covalentă.
Legătura covalentă este atracția electrostatică dintre o pereche de electroni pusă în comun de doi atomi. De cele mai multe ori, o legătură covalentă e reprezentată printr-o linie între cei doi atomi. La molecule mai simple, precum dihidrogenul (adesea scris ca H – H, sau H2), o singură linie reprezintă perechea de electroni care formează o singură legatura între cei doi atomi de hidrogen.
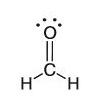 Un model structural complet al unei molecule arată și pozițiile electronilor care nu sunt implicați în legătura covalentă. De exemplu, formahelida (cunoscută și sub numele de formol) este reprezentată precum în imaginea alăturată – cu 4 puncte.
Un model structural complet al unei molecule arată și pozițiile electronilor care nu sunt implicați în legătura covalentă. De exemplu, formahelida (cunoscută și sub numele de formol) este reprezentată precum în imaginea alăturată – cu 4 puncte.
Distribuția sarcinii și proprietatile fizice ale moleculelor
Electronul este o particulă subatomica fundamentală cu sarcina electrică negativă; iar protonul are o sarcină pozitivă. Unele particule nu au un număr egal de protoni și electroni. În acest caz, molecula are o sarcină electrică nenula și se numește ion. Un atom neutru din punct de vedere electric are un număr de electroni egal cu numărul de protoni și se poate ioniza prin schimbarea acestui echilibru. De exemplu, în clorura de sodiu, ionul de sodiu are o sarcină pozitivă, iar ionul de clor are o sarcină negativă.
Dacă pierde unul sau mai mulți electroni devine un ion pozitiv, numit și cation pentru că este atras de catod (electrodul negativ). Dacă primește unul sau mai mulți electroni devine ion negativ, numit și anion pentru că este atras de anod (electrodul pozitiv).
În general, atomii cu electronegativități similare împart aceeași electroni. Carbonul și hidrogenul au electronegativități similare. Fiecare dintre cei doi atomi pune în comun cate un electron și fiecare atrage la fel de mult perechea astfel formată. Acest tip de legătură covalentă se numește legătură nepolară.
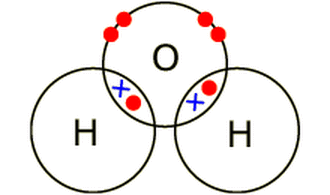 Legătura nepolară apare la atomii din aceeași specie sau la atomii din specii diferite care au electronegativități foarte apropiate.
Legătura nepolară apare la atomii din aceeași specie sau la atomii din specii diferite care au electronegativități foarte apropiate.
Legătura polară există doar între atomi ai nemetalelor din specii diferite. Fiecare dintre cei doi atomi pune în comun câte un electron, dar atomul care are electronegativitatea mai mare atrage mai puternic perechea formată.
Natura și distribuția sarcinii sunt caracteristicile dominante în determinarea proprietăților fizice ale structurii moleculare. Știind că o moleculă este un ion, este, în general, o informație mai importantă decât aproape oricare alta pentru întelegerea comportamentului fizic al moleculei.
Una dintre caracteristicile importante ale moleculelor polare și ale speciilor ionice este capacitatea lor de a se dizolva in solvenți polari. Apa, la rândul său, este unul dintre solvenții polari, deoarece distribuția electronilor este destul de diferită de aranjamentul spațial al protonilor; atomul de oxigen al H2O are mai multă sarcină negativă, în timp ce atomii de hidrogen poartă o încărcătură mai mare.
Ca o consecință, apa dizolvă multe săruri și molecule care au momente mari de dipol. Moleculele nepolare care conțin mai multe unități carbon-hidrogen și carbon-carbon se numesc hidrocarburi și sunt cunoscute sub denumirea de uleiuri și grăsimi. Nepolaritatea lor este și motivul pentru care uleiul și apa nu se amestecă.
Distribuția sarcinii poate fi dedusă din structura moleculelor
Polaritatea moleculelor poate fi dedusă din structura moleculară. Electronegativitatea atomilor este cheia pentru efectuarea acestor deduceri. De exemplu, se poate prezice că glucoza, a cărei structură moleculară prezintă multe legături carbon-oxigen și oxigen-hidrogen, este polară și ușor dizolvabilă în apă, chiar dacă nu este un ion. Astfel de molecule se numesc hidrofile (iubitoare de apă). Pe de altă parte, octanul este nepolar și nu este solubil în apă, dar este solubil în alte uleiuri. Aceste molecule se numesc hidrofobe.
Reactivitatea moleculelor – avantajele și dezavantajele folosirii apei ca solvent
Moleculele care conțin doar legături covalente carbon-carbon sau carbon-hidrogen sunt relativ nereactive la temperaturi normale. Reactivitatea este un concept diferit și nu are legătură cu rezistența legăturii, ci deseori depinde de mediu, deoarece atomii care nu mai sunt legați pot forma legături în altă parte.
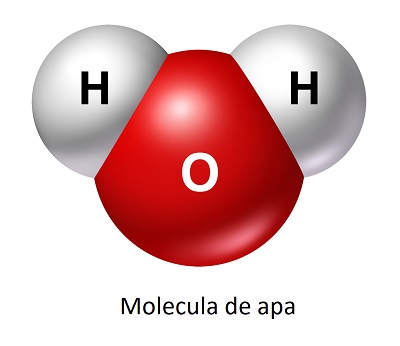 Apa prezintă atât un atom de oxigen cât și doi atomi de hidrogen. Acest lucru are avantaje și dezavantaje pentru un biosolvent. În primul rând, din cauza disponibilității hidrogenului, reacțiile în apă se întâmplă mereu. Astfel, reacțiile care necesită echivalentul unui H+ pot găsi întotdeauna unul în apă. Dezavantajul este ca multe molecule sunt instabile în apă, multe dintre ele fiind necesare în metabolismul organismelor. În unele cazuri, moleculele se descompun prin reacție în apă iar apoi este nevoie ca metabolismul sa le înlocuiască.
Apa prezintă atât un atom de oxigen cât și doi atomi de hidrogen. Acest lucru are avantaje și dezavantaje pentru un biosolvent. În primul rând, din cauza disponibilității hidrogenului, reacțiile în apă se întâmplă mereu. Astfel, reacțiile care necesită echivalentul unui H+ pot găsi întotdeauna unul în apă. Dezavantajul este ca multe molecule sunt instabile în apă, multe dintre ele fiind necesare în metabolismul organismelor. În unele cazuri, moleculele se descompun prin reacție în apă iar apoi este nevoie ca metabolismul sa le înlocuiască.
Multe erori genetice includ depurarea, care apare atunci cand legătura care leagă o purină cu zahărul este ruptă de o moleculă de apă, rezultând o nucleotidă liberă de purină care nu poate acționa ca un șablon în timpul replicarii ADN-ului. Tot prin reacția cu apa, se poate produce deaminarea, adică pierderea unei grupari amino dintr-o nucleotidă. Majoritatea acestor erori sunt corectate prin procesele de reparare a ADN-ului. Dar dacă acest lucru nu se întâmplă, o nucleotidă care se adaugă la fașia nou sintetizată poate deveni o mutație permanentă.
Influența temperaturii asupra stabilității moleculare
Legăturile dintre atomi sunt, fără îndoială, o caracteristică universală, valabil atât pe Pământ cât și în Univers. Temperatura până la care viața bazată pe carbon, hidrogen, oxigen și azot este posibilă poate ajunge până la 327° C – ceva mai mult decât temperatura unui cuptor din bucătăria noastră. Acest lucru este valabil la nivelul mării, deoarece reacțiile de descompunere sunt semnificativ mai lente la presiuni mai mari. Dar indiferent de presiune, putem să considerăm că viața nu poate exista la temperaturi mai mari de 500° C.
Carbohidrații sunt foarte solubili, chiar și la temperaturi cu mult sub punctul de fierbere al apei. Aceasta instabilitate rezulta din faptul ca ele conțin o unitate C = O (un grup carbonil). Datorită acestei instabilități, unii cercetători au sugerat că carbohidrații nu au fost de prea mare ajutor în perioada timpurie a vieții. Cel mai simplu carbohidrat care a fost observat în mediul interstelar este formaldehida, cunoscut și sub numele de formol.
Metabolismul
Compușii construiți exclusiv din carbon și hidrogen nu reacționează usor – și din punct de vedere biologic – compușii organici care conțin numai atomi de carbon și hidrogen nu sunt ușor metabolizați.
Heteroatomii, precum oxigenul, azotul, nitrogenul și sulful, creează oportunități de reactivitate prin activarea legăturilor carbon-carbon și carbon-hidrogen. Viața de pe Pământ folosește oxigenul și azotul în acest scop. Metabolismul exploatează carbonul electrofil dublu legat de azot sau de oxigen.
 Metabolismul nu poate aparea într-un sistem care se află într-un echilibru termodinamic. Sinteza moleculelor și construirea structurilor celulare necesită energie pe care un organism trebuie să o obțină din mediul înconjurator și care trebuie cuplată cu procesele din organism, iar apoi disipată sub formă de caldură sau utilizată pentru a stimula formarea de substanțe nereactive. Cu excepția situației neobișnuite în care compușii energetici sunt utilizați imediat, această energie trebuie stocată într-o formă chimică, ca nucleotida (adenozin trifosfat).
Metabolismul nu poate aparea într-un sistem care se află într-un echilibru termodinamic. Sinteza moleculelor și construirea structurilor celulare necesită energie pe care un organism trebuie să o obțină din mediul înconjurator și care trebuie cuplată cu procesele din organism, iar apoi disipată sub formă de caldură sau utilizată pentru a stimula formarea de substanțe nereactive. Cu excepția situației neobișnuite în care compușii energetici sunt utilizați imediat, această energie trebuie stocată într-o formă chimică, ca nucleotida (adenozin trifosfat).
Unele forme de viață de pe Pământ folosesc ca sursă de energie fotonii proveniți de la Soare, iar altele, energia termică a Pământului. Fotosinteza este procesul primar pentru obținerea energiei de la Soare. Pe de altă parte, organismele non-fotosintetice trebuie să-și obțină energia din compușii consumați.
Plantele obțin energie din lumina provenită de la Soare, iar carbonul și-l obține din CO2 (dioxid de carbon) care este compus dintr-un atom de carbon și 2 atomi de oxigen.
Catalizatorii
Catalizatorii sunt esențiali pentru viață, în procesul de biosinteză proteică, în respirație, sau în procesul de obținere a energiei din hrană. Fără catalizatori anumite reacții chimice ar fi foarte lente sau nu ar avea loc.
Acești catalizatori eficienți sunt produși chiar de organism, sunt de natură proteică și poartă numele de enzime. Enzimele se pot defini drept proteine cu acțiune catalitică; aproape toate moleculele-enzimă cunoscute până acum, dintre care multe obținute sub formă cristalină au structură proteică. Numarul enzimelor este de ordinul miilor, deoarece, în lumea vie, fiecărei molecule organice existente trebuie să-i corespundă cel puțin o enzimă, care să participe la sinteza și / sau degradarea ei.
 Relația dintre apă și biomolecule
Relația dintre apă și biomolecule
Viața pe Pământ folosește apa ca solvent. Așa cum era de așteptat, biomoleculele nu doar că sunt compatibile cu apa, ba chiar o exploatează. ADN-ul are un schelet format din două lanțuri din zahar-fosfat, iar acest lucru face ca ADN-ul să fie solubil în apă. Nucleobazele care codifică informațiile genetie sunt hidrofobe. De aceea, ele se află în interiorul dublu helix-ului, izolate, departe de apă.
Biochimia bazată pe siliciu
Atomul de siliciu a fost propus ca alternativă pentru sistemele biochimice, deoarece siliciul are multe proprietăți chimice similare cu cele ale carbonului și se află în același grup în tabelul periodic cu carbonul. Elementele care creează grupuri funcționale organice cu carbonul includ hidrogenul, oxigenul, axotul, fosforul, sulful și metale precum fierul, magneziul și zincul. Siliciul, pe de altă parte, interacționează cu foarte puține tipuri de atomi. Mai mult, chiar și cu cele cu care interacționează, siliciul creează molecule care au fost descrise de biochimistul Norman R. Pace ca fiind “monotone în comparație cu universul complex al macromoleculelor organice”. Acest lucru se datorează faptului că atomii de siliciu sunt mult mai mari, având o masă mai mare și astfel au dificultăți în formarea de legături duble.
Silanul (tetrahidrura de siliciu), care este un compus chimic al hidrogenului și siliciului sunt analogi hidrocarburilor alcaline, este foarte reactiv cu apa și se descompun spontan. Moleculele care încorporează polimeri de atomi de siliciu și oxigen, în loc de legături directe între siliciu, sunt mult mai stabile. S-a sugerat că substanțele pe bază de siliciu ar fi mai stabile decât hidrocarburile echivalente într-un mediu bogat în acid sulfuric, așa cum este întâlnit pe multe planete din afara sistemului nostru solar.
Dintre moleculele descoperite în mediul interstelar începând cu 1998, 84 se bazează pe carbon, în timp ce numai 8 se bazează pe siliciu. Mai mult, din acești 8 compuși, doar 4 includ carbonul în ele. Carbonul este mult mai abundent în univers și poate creea o mare varietate de compuși complecsi. Chiar dacă Pământul și alte planete sunt bogate în siliciu și sărace în carbon, viața terestră este bazată pe carbon. Acest lucru poate fi o dovada care arată cât de puțin versatil este siliciul în formarea compușilor complecsi.
Chiar și asa, este posibil ca primele organisme să fi folosit siliciul, potrivit ipotezei lui A. G. Carins-Smith, în care a arătat că mineralele din apă au jucat un rol esențial în abiogeneza: puteau să replice structurile lor cristaline, au interacționat cu compușii de carbon și au fost precursori ai vieții bazate pe carbon.
Compușii de siliciu pot fi utili din punct de vedere biologic. Polisilanul, compușii chimici de siliciu corespunzători zaharurilor, sunt solubili în azot lichid, sugerând că aceștia pot juca un rol în biochimie la o temperatură foarte scazută.
Biochimia bazată pe alte elemente
Boranul, numit și trihidrura de bor, se aprinde spontan dacă intră în contact cu aerul, însă ar putea fi mai stabil pe alte planete.
Diferite metale, împreună cu oxigenul, pot forma structuri foarte complexe și stabile din punct de vedere termic, care rivalizează cu cele ale compușilor organici; acizii heteropoli sunt o astfel de familie.
Unii oxizi metalici sunt asemănători cu carbonul în capacitatea lor de a forma atât structuri precum nanotuburile cât și cristale de diamant. Titanul, aluminiul, magneziul și fierul sunt mai abundente în crusta Pământului decât carbonul. Viața bazată pe oxid de metal ar putea fi, prin urmare, o posibilitate în anumite condiții, inclusiv cele în care viața bazată pe carbon ar fi puțin probabilă (de exemplu la temperaturi înalte).
Sulful este, de asemenea, capabil să formeze catene (mai mulți atomi se leagă între ei formând lanțuri). Utilizarea biologică a sulfului ca alternativă la carbon este pur ipotetică, în special deoarece sulful formează de obicei numai lanțuri liniare, nu ramificate.
Arsenicul ca alternativă la fosfor
Arsenicul este similar cu fosforul din punct de vedere chimic, dar în general este otrăvitor pentru formele de viață de pe Pământ. Unele alge marine includ arsenic în moleculele organice, cum ar fi în arsenozaharuri și arsenobetaine. Ciupercile și bacteriile pot produce compuși ai arsenului metilic. Reducerea și oxidarea arsenicului au fost observate la microbi (Chrysiogenes arsenatis). În plus, unele procariote pot utiliza arsenicul ca acceptor de electroni în timpul creșterii anaerobe, iar alții îl pot folosi ca donator de electroni pentru a genera energie.
S-a speculat că cele mai vechi forme de viață de pe Pământ ar fi putut utiliza arsenicul în locul fosforului pentru realizarea structurii ADN-ului.
Autorii unui studiu de geomicrobiologie realizat în anul 2010, susținut de NASA, au arătat că o bacterie, numită GFAJ-1, colectată în sedimentele din lacul Mono din California, poate folosi arsenicul pentru realizarea structurii ADN-ului atunci când bacteria este cultivată într-un mediu fără fosfor. (Link: http://www.nasa.gov)
Solvenții – alternative la apă
Viața terestră necesită apa ca solvent. Acest lucru a dus la discuții despre faptul dacă apa este singurul lichid capabil să îndeplinească acest rol. Ideea că o formă de viață extraterestră s-ar putea baza pe un alt solvent decât apa a fost luată în serios de către biochimistul Steven Benner. Solvenții alternativi includ amoniacul, acidul sulfuric, formamida, hidrocarburile și, la temperaturi și presiuni mult mai mari decât cele de pe Pământ, azotul lichid sau hidrogenul sub formă de fluid supercritic.
Substanțele la o temperatură și o presiune mai mare decât punctul lor critic nu mai prezintă distincție între faza lichidă și faza gazoasă – acesta este un fluid supercritic.
Cercetarea în spațiu
Orice set de reacții interconectate, compatibile cu un mediu geochimic specific, se pot califica drept punct de plecare pentru un metabolism. Deși este posibil să existe doar o singură solutie, anume, viața asa cum o știm pe Pământ, nu există niciun motiv să credem că nu pot exista și alte forme de viață total diferite.
Instrumente pentru detectarea vieții au fost inițial planificate ca parte a încărcăturii roverului Athena, ce a avut ca destinație planeta Marte, însă au fost ulterior eliminate. Un instrument de analiză a carbonului a fost livrat de Beagle 2, dar aceasta misiune a eșuat. Nici Opportunity și Spirit nu au reușit să confirme prezența compusilor organici simpli, chiar dacă locațiile pe care le-au vizitat ar fi putut să conțină.
Poate că satelitul TESS ne va arăta ca nu suntem singuri în Univers. Arthur Clarke spunea că „există două posibilități: fie suntem singuri în Univers fie nu suntem. Ambele sunt la fel de înspăimântătoare”.
Bibliografie:
https://www.nature.com
http://www.nasa.gov
https://en.wikipedia.org
– „The universal nature of biochemistry”. Pace, NR (2001). Proceedings of the National Academy of Sciences of the United States of America. 98 (3): 805–8.
– „The Limits of Organic Life in Planetary Systems” by the National Research Council.
Foto: https://wikimedia.org/









